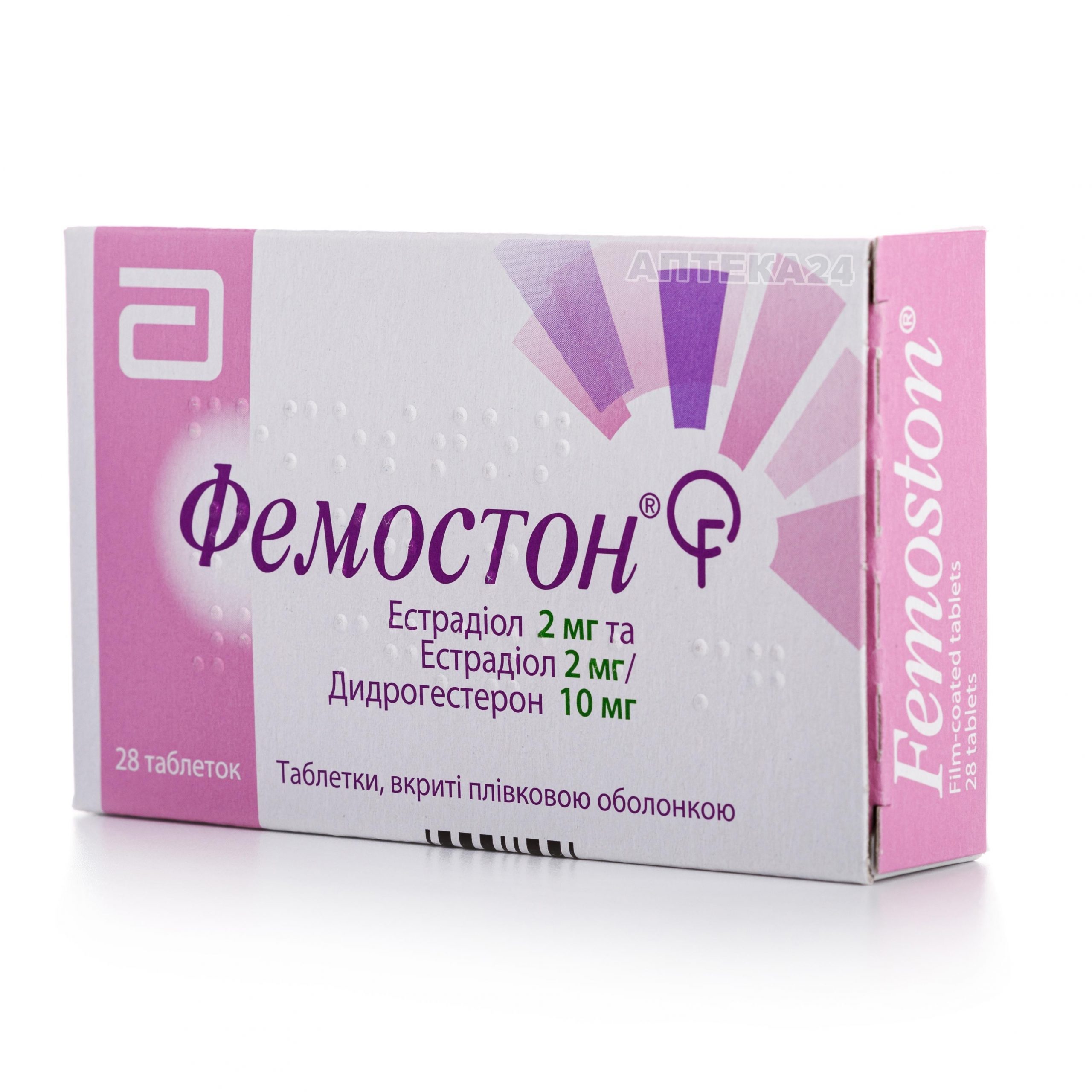
Фемостон 2 мг+10 мг №28 таблетки — Инструкция по применению
Состав
таблетка эстрадиола
действующее вещество: эстрадиол;
1 таблетка содержит эстрадиола гемигидрата микронизированного, что эквивалентно эстрадиола 1 мг или 2 мг
вспомогательные вещества: лактоза моногидрат, гипромеллоза (HPMC 2910), крахмал кукурузный, кремния диоксид коллоидный, магния стеарат
пленочное покрытие: Opadry® Y-1-7000 белый (гипромеллоза (HPMC 2910), полиэтиленгликоль 400, титана диоксид (Е 171)) — для таблеток, содержащих 1 мг эстрадиола;
Opadry® OY-6957 розовый (гипромеллоза (HPMC 2910), полиэтиленгликоль 400, тальк, железа оксид красный (Е172), железа оксид черный (Е172), железа оксид желтый (Е172), титана диоксид (Е 171)) — для таблеток, содержащих 2 мг эстрадиола;
таблетка эстрадиола и дидрогестерона
действующие вещества: эстрадиол; дидрогестерон;
1 таблетка содержит эстрадиола гемигидрата микронизированного, что эквивалентно эстрадиола 1 мг или 2 мг дидрогестерона микронизированного 10 мг
вспомогательные вещества: лактоза моногидрат, гипромеллоза (HPMC 2910), крахмал кукурузный, кремния диоксид коллоидный, магния стеарат
пленочное покрытие: Opadry® ИИ серый 85F27664 (полиэтиленгликоль 3350, тальк (Е 553b), спирт поливиниловый, железа оксид черный (Е172), титана диоксид (Е 171)) — для таблеток, содержащих 1 мг эстрадиола и 10 мг дидрогестерона;
Opadry® OY-02B22764 желтый (гипромеллоза (HPMC 2910), полиэтиленгликоль 400, тальк, железа оксид желтый (Е172), титана диоксид (Е 171)) — для таблеток, содержащих 2 мг эстрадиола и 10 мг дидрогестерона.
Лекарственная форма
Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства:
таблетка, которая содержит 1 мг эстрадиола: круглые, двояковыпуклые, покрытая оболочкой, белая таблетка с маркировкой «379» на одной стороне диаметр 7 мм и вес таблетки примерно 144 мг
таблетка, которая содержит 2 мг эстрадиола: круглые, двояковыпуклые, покрытая оболочкой, кирпично-красная таблетка с маркировкой «379» на одной стороне диаметр 7 мм и вес таблетки примерно 144 мг
таблетка, которая содержит 1 мг эстрадиола и 10 мг дидрогестерона: круглые, двояковыпуклые, покрытая оболочкой, серая таблетка с маркировкой «379» на одной стороне диаметр 7 мм и вес таблетки примерно 144 мг
таблетка, которая содержит 2 мг эстрадиола и 10 мг дидрогестерона: круглые, двояковыпуклые, покрытая оболочкой, желтая таблетка с маркировкой «379» на одной стороне диаметр 7 мм и вес таблетки примерно 144 мг.
Фармакотерапевтичеcкая группа
Препараты для лечения заболеваний мочеполовой системы и половые гормоны. Комбинированные препараты, содержащие прогестагены и эстрогены для последовательного применения.
Код АТХ G03F B08.
Фармакологическое действие
Эстрадиол
Активный компонент 17ß-эстрадиол химически и биологически подобный природного женского полового гормона эстрадиола. Он замещает потерю продукции собственного эстрогена у женщин в период менопаузы и облегчает симптомы менопаузы.
Эстрогены предотвращают потерю массы костной ткани после менопаузы или овариэктомии.
Дидрогестерон
Дидрогестерон — это активный при пероральном приеме прогестаген, действие которого сравнима с действием прогестерона, вводимого парентерально.
В связи с тем, что эстрогены стимулируют рост эндометрия, если не применяется прогестаген, они повышают риск гиперплазии эндометрия и карциномы. Добавление к терапии прогестагена значительно снижает индуцированный эстрогенами риск у женщин с сохраненной маткой.
Данные клинических исследований
Уменьшение симптомов дефицита эстрогенов и улучшение профиля кровотечений.
Уменьшение симптомов менопаузы наблюдалось во время первых нескольких недель лечения.
Регулярные кровотечения отмены продолжительностью в среднем 5 дней при применении препарата Фемостон®, эстрадиола 2 мг + эстрадиола / дидрогестерона 2 мг / 10 мг, наблюдались у 89% женщин. Кровотечение отмены обычно начиналась на 28 день цикла. Прорывные маточные кровотечения или кровянистые выделения регистрировались у 22% женщин в первые 3 месяца лечения и у 19% женщин — в течение 10-12-го месяцев лечения. Аменорея (отсутствие кровотечения или кровянистых выделений) наблюдалась у 12% циклов во время первого года лечения.
Регулярные кровотечения отмены продолжительностью в среднем 5 дней при применении препарата Фемостон®, эстрадиола 1 мг + эстрадиола / дидрогестерона 1 мг / 10 мг, наблюдались у 76% женщин. Кровотечение отмены обычно начиналась в последний день прогестагенов фазы (в среднем на 28 день цикла). Прорывные маточные кровотечения или кровянистые выделения регистрировались примерно у 23% женщин в первые 3 месяца лечения и у 15% женщин — в течение 10-12-го месяцев лечения. Аменорея (отсутствие кровотечения или кровянистых выделений) наблюдалась у 21% циклов во время первого года лечения.
Профилактика остеопороза
Дефицит эстрогенов после наступления менопаузы связано с повышением резорбции костной ткани и уменьшением костной массы. Влияние эстрогенов на плотность костной ткани является дозозависимым. Защитный эффект действует только во время их применения. После прекращения заместительной гормональной терапии (ЗГТ) скорость уменьшения костной массы является такой же, как у женщин, не получавших указанную терапию.
Данные исследования WHI (Women Health Initiative) и метаанализ других исследований свидетельствуют о том, что применение ЗГТ преимущественно у здоровых женщин в виде монотерапии эстрогеном или в сочетании с прогестагена снижает риск переломов бедра, позвонков и других видов переломов, возникающих вследствие остеопороза. ЗГТ также может предотвращать переломы у женщин с низкой плотностью костной ткани и / или диагностированным остеопорозом, но данные об этом ограничены.
После двух лет лечения Фемостон®, эстрадиола 2 мг + эстрадиола / дидрогестерона 2 мг / 10 мг, плотность костной ткани (ЩКТ) в поясничном отделе позвоночника увеличилась на 6,7 ± 3,9% (среднее значение ± стандартное отклонение). Плотность костной ткани в поясничном отделе позвоночника возросла или осталась неизменной в 94,5% женщин.
У женщин, принимавших препарат Фемостон®, эстрадиола 1 мг + эстрадиола / дидрогестерона 1 мг / 10 мг, плотность костной ткани в поясничном отделе позвоночника увеличилась на 5,2 + 3,8% (среднее значение ± стандартное отклонение). Плотность костной ткани в поясничном отделе позвоночника возросла или осталась неизменной в 93,0% женщин.
Фемостон® также влиял на ЩКТ бедренной кости.
После двух лет лечения Фемостон®, эстрадиола 2 мг + эстрадиола / дидрогестерона 2 мг / 10 мг, ЩКТ увеличилась на 2,6 ± 5,0% (среднее значение ± стандартное отклонение) шейке бедренной кости, на 3,5 ± 5 0% (среднее значение ± стандартное отклонение) в зоне вертела и на 4,1 ± 7,4% (среднее значение ± стандартное отклонение) в зоне треугольника Варда. ЩКТ в трех зонах бедренной кости возросла или осталась неизменной после лечения Фемостон®, эстрадиола 2 мг + эстрадиола / дидрогестерона 2 мг / 10 мг, в 71-88% женщин.
После двух лет терапии препаратом препарат Фемостон®, эстрадиола 1 мг + эстрадиола / дидрогестерона 1 мг / 10 мг, ЩКТ в шейке бедренной кости увеличилась на 2,7 ± 4,2% (среднее значение ± стандартное отклонение), на 3,5 ± 5,0% (среднее значение ± стандартное отклонение) — в зоне вертела и на 2,7 ± 6,7% (среднее значение ± стандартное отклонение) — в треугольнике Варда. ЩКТ в трех зонах бедренной кости возросла или осталась неизменной после лечения Фемостон®, эстрадиола 1 мг + эстрадиола / дидрогестерона 1 мг / 10 мг, в 67-78% женщин.
Фармакокинетика
Всасывание
Всасывание эстрадиола зависит от размера частиц: микронизированный эстрадиол быстро всасывается из желудочно-кишечного тракта.
В таблице 1 представлены средние постоянные фармакокинетические показатели эстрадиола (Е2), эстрона (Е1) и эстрона сульфата (Е1S) для каждой дозы микронизированного эстрадиола.
Данные представлены как средние (SD).
Таблица 1
Эстрадиол 1 мг
|
Параметры |
E2 |
E1 |
Параметры |
E1S |
|
Cmax(пг/мл) |
71 (36) |
310 (99) |
Cmax (нг/мл) |
9,3 (3,9) |
|
Cmin (пг/мл) |
18,6 (9,4) |
114 (50) |
Cmin (нг/мл) |
2,099 (1,340) |
|
Cav (пг/мл) |
30,1 (11,0) |
194 (72) |
Cav (нг/мл) |
4,695 (2,350) |
|
AUC0—24 (пг*час/мл) |
725 (270) |
4767 (1857) |
AUC0—24 (нг*час/мл) |
112,7 (55,1) |
Эстрадиол 2 мг
|
Параметры |
E2 |
E1 |
Параметры |
E1S |
|
Cmax (пг/мл) |
103,7 (48,2) |
622,2 (263,6) |
Cmax (нг/мл) |
25,9 (16,4) |
|
Cmin (пг/мл) |
48(30) |
270 (138) |
Cmin (нг/мл) |
5,7 (5,9) |
|
Cav (пг/мл) |
68 (31) |
429 (191) |
Cav (нг/мл) |
13,1 (9,4) |
|
AUC0-24 (пг*час/мл) |
1619 (733) |
10209 (4561) |
AUC0-24 (нг*час/мл) |
307,3 (224,1) |
Распределение
Эстрогены определяются в несвязанном или связанном состоянии. Около 98-99% дозы эстрадиола связывается с белками плазмы крови, из которых 30-52% с альбумином и около 46-69% с глобулином, связывающим половые гормоны (ГСПГ).
Метаболизм
После приема внутрь эстрадиол активно метаболизируется. Основными неконъюгированного и конъюгированными метаболитами являются эстрон и эстрона сульфат. Эти метаболиты могут способствовать эстрогенной активности непосредственно или после превращения в эстрадиол. Эстрона сульфат может проходить через энтерогепатическую циркуляцию.
Выведение
В моче основными соединениями являются глюкурониды эстрона и эстрадиола. Период полувыведения составляет от 10 до 16 часов. Эстрогены секретируются в грудное молоко.
Зависимость от дозы и времени
При ежедневном пероральном приеме препарата Фемостон® концентрация эстрадиола достигает равновесного состояния примерно через пять дней. В большинстве случаев концентрация равновесного состояния достигается в промежутке от 8 до 11 дня приема.
Дидрогестерон
Всасывание.
После приема внутрь дидрогестерон быстро всасывается из Tmax 0,5-2,5 ч .. Абсолютная биодоступность дидрогестерона (пероральная доза 20 мг по сравнению с внутривенной инфузии 7,8 мг) составляет 28%.
В таблице 2 представлены средние постоянные фармакокинетические показатели дидрогестерона (Д) и дигидродидрогестерон (ПГД).
Данные представлены как средние (SD).
Таблица 2
Дидрогестерон 10 мг
|
Параметры |
Д |
ДГД |
|
Cmax(нг/мл) |
2,54 (1,80) |
62,50 (33,10) |
|
Cmin(нг/мл) |
0.13 (0.07) |
3,70 (1,67) |
|
Cav(нг/мл) |
0.42 (0.25) |
13,04 (4,77) |
|
AUC0-t (нг*год/мл) |
9,14 (6,43) |
311,17 (114,35) |
Распределение
После введения дидрогестерона равновесное объем распределения составляет примерно 1400 л. Дидрогестерон и ПГД связываются с белками плазмы крови более чем на 90%.
Метаболизм
После приема внутрь дидрогестерон быстро метаболизируется с образованием ПГД. Уровне основного метаболита 20α-дигидродидрогестерон (ПГД) достигают пика примерно через 1,5 часа после приема. Уровни ПГД в плазме крови в основном выше по сравнению с первоначальным продуктом. Отношение AUC и Cmax ПГД и дидрогестерона составляют около 40 и 25 соответственно. Средний конечный период полувыведения дидрогестерона и ПГД колеблется между 5-7 и 14-17 часами соответственно.
Общим свойством всех метаболитов является сохранение 4,6-диен-3-онов конфигурации исходного соединения и отсутствие 17α-гидроксилирования. Этим объясняется отсутствие эстрогенного и андрогенного эффектов дидрогестерона.
Выведение
После приема меченого дидрогестерона в среднем 63% дозы выводится с мочой. Общий клиренс составляет 6,4 л / мин. Полный вывод осуществляется в течение 72 часов. ПГД присутствует в моче преимущественно в виде конъюгата с глюкуроновой кислотой.
Зависимость от дозы и времени
Фармакокинетика при однократном и многократном применении имеет линейный характер в диапазоне пероральных доз от 2,5 до 10 мг. Сравнение кинетики одноразовой и многоразовой доз показывает, что фармакокинетика дидрогестерона и ПГД не меняется в случае повторного применения. Равновесное состояние достигалось после 3 дней лечения.
Показания
Заместительная гормональная терапия (ЗГТ) для устранения симптомов, обусловленных дефицитом эстрогенов у женщин в менопаузный период не ранее чем через 6 месяцев с момента последней менструации.
Профилактика остеопороза у женщин в постменопаузальный период при высоком риске переломов. Фемостон® следует применять пациентам только в случае непереносимости или наличии противопоказаний к применению других лекарственных препаратов для профилактики остеопороза (см. Раздел «Особенности применения»).
Опыт лечения женщин старше 65 лет ограничен.
Противопоказания
-
Диагностирован в прошлом, имеющийся или подозреваемый рак молочной железы;
-
установленные или подозреваемые естрогенчутливи опухоли (например рак эндометрия)
-
вагинальные кровотечения неясного генеза;
-
нелеченная гиперплазия эндометрия
-
активная венозная тромбоэмболия в анамнезе (тромбоз глубоких вен, тромбоэмболия легочных артерий)
-
наличие тромбофилических расстройств (например дефицит протеина С, протеина S или антитромбина см. Раздел «Особенности применения»);
-
острое или недавно перенесенное тромбоэмболические заболевания артерий (например стенокардия, инфаркт миокарда);
-
острое заболевание печени или заболевания печени в анамнезе, при котором показатели функции печени не нормализовались;
-
известная гиперчувствительность к действующим веществам или к любому из вспомогательных веществ препарата
-
порфирия.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исследования лекарственных взаимодействий не проводились.
Эффективность эстрогенов и прогестагенов может нарушаться.
- Метаболизм эстрогенов (и прогестагенов) может усиливаться при одновременном применении веществ с известной способностью индуцировать ферменты, участвующие в метаболизме лекарственных средств. Это, в частности, касается ферментов Р450. К таким веществам относятся противосудорожные средства (фенобарбитал, карбамазепин, фенитоин) и антибактериальные / противовирусные средства (например рифампицин, рифабутин, невирапин, эфавиренз).
- Несмотря на то, что ритонавир и нелфинавир известны как мощные ингибиторы, они на самом деле имеют индуцирующий эффект при одновременном применении с нестероидными гормонами.
- Растительные препараты, компонентом которых является зверобой перфорированный (Hypericum perforatum), могут также усиливать метаболизм эстрогенов (и прогестагенов).
- Клинически повышенный метаболизм эстрогенов и прогестагенов может проявляться снижением эффективности и изменениями профиля кровотечений.
Особенности применения
Для лечения симптомов дефицита эстрогенов у женщин в период менопаузы лечение с помощью ЗГТ следует начинать, только если эти симптомы в значительной степени неблагоприятно влияют на качество жизни. Регулярно необходимо проводить тщательную оценку пользы и рисков ЗГТ, как минимум ежегодно и лечение целесообразно продолжать, только если польза превышает риски.
Данные о рисках, связанных с ЗГТ при лечении преждевременной менопаузы, ограничены. Однако благодаря низкому уровню абсолютного риска у женщин молодого возраста соотношение пользы и риска у таких женщин является более благоприятным, чем у женщин старшего возраста.
Медицинское обследование / последующее наблюдение
Перед началом ЗГТ или в случае необходимости обновления ЗГТ после перерыва необходимо выяснить полный медицинский анамнез (включая семейный анамнез). Физикальное обследование (включая гинекологическое обследование и обследование молочных желез) необходимо делать, учитывая данные анамнеза, противопоказания и предостережения к применению. Во время лечения рекомендуется проводить регулярные осмотры, частота и объем которых определяется индивидуально. Женщин следует проинформировать, о каких изменениях в молочных железах необходимо сообщать врачу или медицинской сестре (см. Ниже «Рак молочной железы»). Регулярное обследование молочных желез, включая соответствующие методы визуализации, например маммографию, следует проводить в соответствии с действующими руководств для здоровых женщин, учитывая медицинские нужды индивидуально для каждой женщины.
Заболевания, при которых необходимо наблюдать за состоянием пациенток
При наличии любого из указанных ниже заболеваний в данный момент, в прошлом и / или их ухудшении во время беременности или предыдущей гормональной терапии пациенткам следует находиться под тщательным наблюдением. Необходимо иметь в виду, что эти состояния могут рецидивировать или их ход ухудшаться во время лечения Фемостон®. К ним относятся:
-
лейомиома (миома матки) или эндометриоз;
-
факторы риска тромбоэмболических заболеваний (см. Ниже);
-
факторы риска естрогенчутливих опухолей, например первая степень наследственной предрасположенности к раку молочной железы;
-
артериальная гипертензия;
-
заболевания печени (аденома печени);
-
сахарный диабет с сосудистыми симптомами или без них;
-
желчнокаменная болезнь;
-
мигрень или (сильная) головная боль
-
системная красная волчанка,
-
гиперплазия эндометрия в анамнезе (см. Ниже);
-
эпилепсия
-
бронхиальная астма;
-
отосклероз;
-
менингиома.
Причины для немедленного прекращения терапии
Заместительную гормональную терапию необходимо прекратить немедленно в случае выявления противопоказания, а также в следующих ситуациях:
-
появление желтухи или нарушение функции печени
-
значительное повышение артериального давления;
-
появление впервые мигренеподобной головной боли
-
беременность.
Гиперплазия эндометрия и карцинома
У женщин с неудаленной маткой риск возникновения гиперплазии эндометрия и рака эндометрия повышается при длительном применении ЗГТ только эстрогенами. Замечено возрастание риска рака эндометрия у женщин, принимающих только препараты эстрогена, колеблется от 2 до 12 раз по сравнению с теми, кто не принимает их, в зависимости от продолжительности лечения и дозы эстрогена (см. Раздел «Побочные реакции»). После прекращения лечения риск может оставаться повышенным в течение как минимум 10 лет.
Циклическая комбинация препарата эстрогена с прогестагена в течение по крайней мере 12 дней в месяц / на 28-дневный цикл или непрерывная комбинированная эстроген-прогестагенов терапия у женщин с сохраненной маткой предотвращает чрезмерное риска, ассоциированном с применением только препаратов эстрогена.
В течение первых месяцев лечения могут возникать прорывные маточные кровотечения или кровянистые выделения. Если они возникают через некоторое время после начала лечения или продолжаются после прекращения терапии, необходимо выяснить их причину, в том числе путем проведения биопсии эндометрия для исключения злокачественных новообразований.
Рак молочной железы
Все имеющиеся данные свидетельствуют о повышенном риске рака молочной железы у женщин, принимающих комбинированную эстроген-прогестагенов ЗГТ, и, вероятно, также у женщин, принимающих только эстрогенов ЗГТ. Этот риск зависит от длительности применения.
Комбинированная эстроген-прогестагенов терапия
Как рандомизированное плацебо-контролируемое исследование «Инициативы ради здоровья женщин» (Women’s Health Initiative Study — WHI), так и эпидемиологические исследования согласовано показали повышенный риск возникновения рака молочной железы у женщин, применяющих комбинированную эстроген-прогестагенов ЗГТ. Повышенный риск становится очевидным примерно после 3 лет (см. Раздел «Побочные реакции»).
Монотерапия эстрогенами
Исследование WHI не выявило повышение риска возникновения рака молочной железы у женщин после гистерэктомии, которые принимают ЗГТ только препаратами эстрогена. В экспериментальных исследованиях преимущественно сообщалось о незначительном повышении риска диагностирования рака молочной железы, который существенно ниже, чем у пациенток, принимающих комбинации эстрогенов и прогестагенов (см. Раздел «Побочные реакции»).
Повышенный риск становится очевидным уже через несколько лет применения и повышается по мере увеличения длительности применения, однако после прекращения лечения возвращается к исходному уровню в течение нескольких (максимум 5) лет.
Заместительная гормональная терапия, особенно комбинированная эстроген-прогестагенов терапия, повышает плотность маммографических изображений, что может негативно повлиять на радиологическое выявления рака молочной железы.
Рак яичников
Рак яичников возникает значительно реже, чем рак молочной железы. Эпидемиологические данные, полученные в результате широкого метаанализа, показали несколько повышенный риск у женщин, которым применяют монотерапии эстрогеном или комбинацию эстрогена с прогестагена как заместительную гормональную терапию, этот риск проявляется в течение 5 лет применения и уменьшается со временем после прекращения терапии. Некоторые другие исследования, в частности исследования WHI | свидетельствуют | свидетельствуют |, что применение | употребления | комбинированных ЗГТ может быть связано с таким же или несколько ниже риском (см. раздел «Побочные реакции»).
Венозная тромбоэмболия
ЗГТ связана с 1,3-3-кратным повышением риска развития венозной тромбоэмболии (ВТЭ), то есть тромбоза глубоких вен или эмболии легочных сосудов. Возникновение такой патологии наиболее вероятно в течение первого года проведения ЗГТ (см. Раздел «Побочные реакции»).
Пациентки с известными тромбофилических осложнениями имеют повышенный риск ВТЭ, а ЗГТ может дополнительно увеличивать этот риск. Поэтому заместительная гормональная терапия противопоказана для этой группы пациенток (см. Раздел «Противопоказания»).
Общепризнанными факторами риска ВТЭ являются: применение эстрогенов, старший возраст, большие хирургические вмешательства, длительная иммобилизация, ожирение (ИМТ> 30 кг / м2), беременность / послеродовой период, системная красная волчанка (СКВ) и карцинома. Единого мнения относительно роли варикозного расширения вен в развитии ВТЭ не существует.
Как и для всех послеоперационных пациентов, необходимо принять меры для предупреждения ВТЭ после хирургического вмешательства. Если после плановой операции ожидается длительная иммобилизация, рекомендуется временное прекращение ЗГТ за 4-6 недель до вмешательства. Лечение можно возобновлять, только когда женщина полностью восстановит свою подвижность.
Женщинам без ВТЭ в анамнезе, но с наличием у родственников первой степени родства тромбоза в молодом возрасте, можно предложить скрининг после тщательного обсуждения его ограничений (с помощью скрининга обнаруживают только часть тромбофилических расстройств).
Если идентифицировано врожденный тромбофилических расстройство, которое сопровождается тромбозом у членов семьи в анамнезе, или если расстройство является тяжелым (например, недостаточность антитромбина, протеина S или протеина С или комбинация расстройств), ЗГТ противопоказана.
У женщин, которые уже принимают постоянное антикоагулянтную терапию, следует тщательно взвесить пользу и риски применения ЗГТ.
Если ВТЭ развивается после начала терапии, препарат нужно немедленно отменить. Пациенток следует предупредить о необходимости немедленно обратиться к врачу при появлении потенциальных симптомов тромбоэмболии (например мучительной отечности ноги, внезапной боли в грудной клетке, одышка).
Ишемическая болезнь сердца (ИБС)
Есть полученных в ходе рандомизированных контролируемых исследований доказательств защиты от инфаркта миокарда у женщин с или без ИБС, принимавших комбинированную эстроген-прогестагенов ЗГТ или ЗГТ только эстрогеном.
Комбинированная эстроген-прогестагенов терапия
Относительный риск возникновения ИБС на фоне применения комбинированной эстроген-прогестагенов ЗГТ является несколько повышенным. Поскольку базовый абсолютный риск ИБС в значительной степени зависит от возраста, количество дополнительных случаев ИБС, обусловленных применением эстрогенов и прогестагенов, очень мала у здоровых женщин в близком к менопаузе возрасте, но будет расти в старшем возрасте.
Монотерапия эстрогенами
Данные рандомизированных контролируемых исследований не показали повышенного риска ИБС у женщин после гистерэктомии, которые принимают монотерапии эстрогеном.
Ишемический инсульт
Комбинированная эстроген-прогестагенов терапия и монотерапия эстрогенами ассоциируются с повышением риска ишемического инсульта в 1,5 раза. Относительный риск не меняется с возрастом или временем, прошедшим после наступления менопаузы. Однако поскольку базовый абсолютный риск инсульта в значительной степени зависит от возраста, общий риск инсульта у женщин, принимающих ЗГТ, будет расти с возрастом (см. Раздел «Побочные реакции»).
Другие состояния
-
Эстрогены могут вызывать задержку жидкости, и поэтому необходимо внимательно следить за состоянием пациентов с нарушением функции сердца или почек.
-
Женщины с имеющейся гипертриглицеридемией должны находиться под тщательным наблюдением во время проведения заместительной терапии эстрогенами или гормональной заместительной терапии, поскольку в редких случаях у женщин с данной патологией уровень триглицеридов в плазме крови значительно увеличивался при лечении эстрогенами, что приводило к панкреатиту.
-
Эстрогены повышают уровень тироксинсвязывающего глобулина (ТСГ), приводя к увеличению циркулирующих гормонов щитовидной железы, который определяют по уровню связанного с белком йода (ЙЗБ), уровнями Т4 (при анализе с использованием колонок или радиоиммунном анализе) или уровнями Т3 ( с помощью радиоиммунного анализа). Интересы трийодтиронина (Т3) уменьшено в результате повышенных уровней ТСГ. Концентрации свободных трийодтиронина (Т3) и тироксина (Т4) не изменяются. Уровни других связывающих белков в сыворотке, кортикоидзвьязуючого глобулина (КЗГ) и глобулина, связывающего половые гормоны (СГЗГ), могут повышаться, что приводит к увеличению концентрации кортикостероидов и половых гормонов в крови. Концентрации свободных и / или биологически активных гормонов не изменяются. Могут расти концентрации других белков плазмы (ангиотензин-ренин субстрата, альфа-I-антитрипсина, церулоплазмина).
-
ЗГТ не улучшает когнитивных функций. Нет доказательств по повышенного риска возможной деменции у женщин, начинающих лечение комбинированными препаратами или препаратами эстрогена в возрасте 65 лет.
-
Пациенткам с редкими наследственными заболеваниями, такими как непереносимость галактозы, недостаточность лактазы или синдром мальабсорбции глюкозы-галактозы, не следует принимать этот препарат.
-
Фемостон® не относится к средствам контрацепции.
Способность влиять на скорость реакции при управлении автотранспортом или работе с механизмами
Фемостон® не влияет или оказывает незначительное влияние на способность управлять автомобилем или работать с механизмами.
Применение в период беременности или кормления грудью
Фемостон® не показан для применения в период беременности. Если беременность наступила во время лечения Фемостон®, прием препарата следует немедленно прекратить.
Достаточных данных относительно применения эстрадиола / дидрогестерона женщинам в период беременности нет.
В научной литературе сообщалось, что применение некоторых прогестагенов было связано с повышенным риском развития гипоспадии. Однако через смешанные факторы во время беременности, нельзя окончательно определиться по содействию прогестагенов развития гипоспадии.
На сегодня результаты большинства эпидемиологических исследований относительно случайного воздействия на плод комбинации эстрогенов и прогестагенов указывают на отсутствие тератогенного или токсического риска для плода.
Кормление грудью
Фемостон® не показан для применения в период кормления грудью.
Влияние на способность забеременеть.
Фемостон® не показан для применения женщинам детородного возраста.
Способ применения и дозы
Фемостон® применяют внутрь ежедневно согласно непрерывного последовательного режима так, как описано ниже.
Лечение начинается с приема одной таблетки, содержащей 1 мг или 2 мг эстрадиола 1 раз в сутки, ежедневно в течение первых 14 дней 28-дневного цикла.
После этого в течение последующих 14 дней по 1 таблетке, содержащей 1 мг или 2 мг эстрадиола и 10 мг дидрогестерона, 1 раз в сутки, как указано на 28-дневной календарной упаковке.
После окончания 28-дневного цикла, на 29 день, следует сразу же начинать новый 28-дневный цикл.
Циклы лечения следуют друг за другом и являются непрерывными.
Для лечения дефицита эстрогенов у женщин в постменопаузальный период как начальную и поддерживающую дозы следует принимать самую низкую эффективную дозу, а продолжительность периода лечения должна быть как можно короткой (также см. Раздел «Особенности применения»).
В общем последовательное комбинированное лечение следует начинать с препарата Фемостон®, эстрадиола 1 мг + эстрадиола / дидрогестерона 1 мг / 10 мг.
Дозу следует подбирать индивидуально, в зависимости от клинического ответа.
У женщин, не применяющих заместительную гормональную терапию, или у женщин, переходящих с непрерывной комбинированной заместительной гормональной терапии, лечение можно начать в любой удобный день. У женщин, которые переходят из циклической или непрерывной последовательной заместительной гормональной терапии, лечение следует начинать сразу со следующего дня после окончания предыдущего цикла.
Если прием таблетки пропущен, рекомендуется продолжать по приему следующей таблетки, не приемля пропущенную таблетку. В случае пропуска приема таблетки может повышаться вероятность прорывного кровотечения или кровянистых выделений.
Фемостон® можно принимать независимо от приема пищи.
Дети
Отсутствует целесообразность применения препарата Фемостон® для этой категории пациентов.
Передозировка
Как эстрадиол, так и дидрогестерон являются веществами с низкой токсичностью. При передозировке могут возникать такие симптомы, как тошнота, рвота, чувствительность молочных желез, головокружение, боль в животе, сонливость / утомляемость и кровотечение отмены. Маловероятно, что при передозировке потребуется любое специфическое или симптоматическое лечение.
Описанная выше информация также касается передозировки у детей.
Побочные реакции
Наиболее частыми побочными реакциями у пациентов, которым применяли терапию эстрадиолом / дидрогестероном при проведении клинических исследований, были головная боль, боль в животе, боль / чувствительность молочных желез и боль в пояснице.
Во время клинических исследований (n = 4929) наблюдались побочные реакции, представленные в таблице 3, с указанной ниже частотой.
Таблица
3
|
Класы систем |
Очень часто (≥ |
Часто (≥ 1/100, |
Нечасто (≥ 1/1000, |
Редко (≥ 1/10000 до
|
|
Инфекциы и паразитарные заболевания |
Вагинальный кандидоз |
Циститподобный |
||
|
Новообразования доброкачественные, злокачественные и неуточненные |
Увеличение размера миомы |
|||
|
Со стороны системы крови и лимфатической системы |
Гемолитическая анемия* |
|||
|
Со стороны иммунной системы |
Гиперчувствительность |
|||
|
Со стороны психики |
Депрессия, нервозность |
Влияние на либидо |
||
|
Со стороны центральной нервной системы |
Головная боль |
Мигрень, головокружение |
Менингиома* |
|
|
Со стороны органов зрения |
Увеличение кривизны роговицы*. Непереносимость контактных линз* |
|||
|
Со стороны серца |
Инфаркт миокарда |
|||
|
Сосудистые расстройства |
Венозная тромбоэмболия*, артериальная гипертензия, заболевания периферических сосудов, варикоз |
Инсульт* |
||
|
Со стороны желудочно-кишечного тракта |
Боль в животе |
Тошнота, рвота, метеоризм |
Диспепсия |
|
|
Со стороны пищеварительной системы |
Нарушение функции печени (в некоторых случаях с желтухой, астенией или недомоганием и болью в животе), заболевания желчного пузыря |
|||
|
Со стороны кожи и подкожной клетчатки |
Аллергические кожные реакции (например сыпь, крапивница, зуд) |
Ангионевротичный отек, узловая эритема*, сосудистая пурпура хлоазма или мелазма, которые могут храниться при отмене лечения* |
||
|
Со стороны костно-мышечной системы и соединительной ткани |
Боль в спине |
Судороги нижних конечностей* |
||
|
Со стороны репродуктивной системы и молочных желез |
Боль/чувствительность молочных желез |
Нарушение менструального цикла (включая постменопаузальный кровянистые выделения, метроррагия, меноррагию, олиго-/ аменорея, нерегулярные менструации, дисменорея) боль в области таза, цервикальные выделения |
Увеличение молочных желез, передменст-руальний синдром (ПМС) |
|
|
Общие нарушения и реакции в месте введения |
Астенические состояния (астения, усталость, плохое самочувствие), периферический отек |
|||
|
Отклонение от нормы, выявленные в результате обследования |
Увеличение массы тела |
Уменьшение массы тела |
|
* Побочные реакции, о которых сообщалось с спонтанных сообщений, которых нет во время клинических исследований добавлено в частоту «редко».
Риск рака молочной железы
Сообщается о повышен до 2 раз риск диагностирования рака молочной железы у женщин, принимающих комбинированную эстроген-прогестагенов терапию в течение более 5 лет.
Повышенный риск у женщин, принимающих монотерапии эстрогеном, существенно ниже, чем у женщин, принимающих комбинированную эстрогена-прогестагенов терапию.
Уровень риска зависит от длительности применения (см. Раздел «Особенности применения»).
Ниже представлены результаты крупнейшего рандомизированного плацебо-контролируемого исследования Women’s Health Initiative (WHI) и крупнейшего эпидемиологического исследования Million Women Study (MWS).
Таблица
4
Исследование «Million Women Study» (MWS): рассчитан дополнительный риск рака молочной железы после 5 лет применения
|
Возрастной диапазон (лет) |
Количество дополнительных случаев на 1000 женщин, которые никогда не принимали ЗГТ, за 5-летний период1 |
Отношение риска # |
Количество дополнительных случаев на 1000 женщин, принимающих ЗГТ, за 5-летний период (95% ИД) |
|
ЗГТ с применением только эстрогенов |
|||
|
50-65 |
9-12 |
1,2 |
1-2 |
|
ЗГТ с применением комбинации эстрогена и прогестагена |
|||
|
50-65 |
9-12 |
1,7 |
6 |
|
# Отношение общего риска. Отношение риска не является постоянным и будет расти с увеличением продолжительности лечения. Примечание. Поскольку заболеваемость раком молочной железы отличается в каждой стране ЕС, количество дополнительных случаев рака молочной железы также пропорционально изменится. 1 Взятые от базовых показателей заболеваемости в развитых странах. |
|||
Таблица
5
Исследование WHI в США: дополнительный риск рака молочной железы после 5 лет применения
|
Возрастной диапазон (лет) |
Количество случаев на 1000 женщин в группе плацебо в течение 5 лет |
Отношение риска и 95% интервала доверия (ИД) |
Количество дополнительных случаев на 1000 женщин, принимающих ЗГТ в течение 5 лет (95% ИД) |
|
Заместительная гормональная монотерапия эстрогеном ККЭ |
|||
|
50-79 |
21 |
0,8 |
-4 |
|
ККЭ+MПA |
|||
|
50-79 |
17 |
1,2 |
+4 |
|
‡ При ограниченном анализе с участием женщин, которые не применяли ЗГТ до начала исследования, явного риска в течение первых 5 лет лечения не наблюдалось; после 5 лет риск был выше, чем у тех, кто не применял ЗГТ. 2 WHI-исследования с участием женщин с отсутствующей маткой, не показали увеличения риска развития рака молочной железы. ККЭ — конъюгированный конский эстроген, МПА — медроксипрогестерона ацетат |
|||
Риск рака эндометрия
Женщины в периоде постменопаузы с сохраненной маткой
Риск рака эндометрия составляет около 5 случаев на каждую 1000 женщин с сохраненной маткой, которые не принимают ЗГТ.
Женщинам с сохраненной маткой не рекомендуется ЗГТ с применением только эстрогена, поскольку это повышает риск рака эндометрия (см. Раздел «Особенности применения»). В зависимости от продолжительности монотерапии эстрогеном и дозы эстрогена повышение риска рака эндометрия в ходе эпидемиологических исследований колебалось от 5 до 55 дополнительных случаев, диагностированных в каждой 1000 женщин в возрасте от 50 до 65 лет.
Добавление прогестагена к монотерапии эстрогеном в течение по крайней мере 12 дней на цикл может предотвратить такое повышение риска. В ходе исследования Million Women Study применения в течение пяти лет комбинированной (последовательной или постоянной) ЗГТ не повышала риска рака эндометрия (отношение риска 1,0 (0,8-1,2)).
Рак яичников
Применение ЗГТ только эстрогеном или комбинированной эстроген-прогестагенов ЗГТ ассоциировалось с несколько повышенным риском рака яичников (см. Раздел «Особенности применения»).
В данных метаанализа, полученных из 52 эпидемиологических исследований, сообщалось о повышенном риске развития рака яичников у женщин, получавших ЗГТ, по сравнению с женщинами, которые никогда не применяли ЗГТ (отношение риска 1,43, 95% CI 1,31-1,56 ). У женщин в возрасте от 50 до 54 лет, которые применяли ЗГТ в течение 5 лет, это вызывало 1 дополнительный случай на 2000 женщин. У женщин в возрасте от 50 до 54 лет, не применяли ЗГТ, рак яичников диагностируется примерно в 2 на 2000 женщин в течение 5 лет.
Риск венозной тромбоэмболии
ЗГТ связана с 1,3-3-кратным повышением риска развития венозной тромбоэмболии (ВТЭ), то есть тромбоза глубоких вен или эмболии легочной артерии. Возникновение такого явления является более вероятным в первый год применения ЗГТ (см. Раздел «Особенности применения»). Ниже представлены результаты исследований WHI.
Таблица
6
Исследование WHI: дополнительный риск ВТЭ в течение 5 лет применения
|
Возрастной диапазон (лет) |
Количество случаев на 1000 женщин в группе плацебо в течение 5 лет |
Отношение риска и 95 |
Количество дополнительных случаев на 1000 женщин, принимающих ЗГТ в течение 5 лет (95% |
|
Пероральная заместительная гормональная монотерапия естрогеном3 |
|||
|
50-59 |
7 |
1,2 |
1 |
|
Пероральный прием комбинации эстрогена и прогестагена |
|||
|
50-59 |
4 |
2,3 |
5 |
3 Исследование с участием женщин с отсутствующей маткой
Риск ишемической болезни сердца
Риск ишемической болезни сердца несколько повышен у женщин, принимающих комбинированную эстроген-прогестагенов ЗГТ в возрасте более 60 лет (см. Раздел «Особенности применения»).
Риск ишемического инсульта
Применение монотерапии эстрогеном и комбинированной эстроген-прогестагенов ЗГТ ассоциируется с повышением относительного риска ишемического инсульта в 1,5 раза. Риск геморрагического инсульта не растет на фоне применения ЗГТ.
Относительный риск не зависит от возраста или длительности применения, но поскольку базовый риск в значительной степени зависит от возраста, общий риск инсульта у женщин, принимающих ЗГТ, будет расти с возрастом (см. Раздел «Особенности применения»).
Таблица
7
Объединенные данные исследований WHI: дополнительный риск ишемического инсульту4 течение 5-летнего применения
|
Возрастной диапазон (лет) |
Количество случаев на 1000 женщин в группе плацебо в течение 5 лет |
Отношение риска и 95 % ІД |
Количество дополнительных случаев на 1000 женщин, принимающих ЗГТ в течение 5 лет (95% ІД) |
|
50-59 |
8 |
1,3 |
3 |
4Разницы между ишемическим и геморрагическим инсультом не было
Другие побочные реакции, о которых сообщалось в связи с эстроген / прогестагенов терапией:
- новообразования доброкачественные, злокачественные и неопределенной этиологии: эстрогензависимость новообразования как доброкачественные, так и злокачественные, например рак эндометрия и рак яичников; увеличение размера менингиомы;
- нарушения со стороны иммунной системы: системная красная волчанка (СКВ)
- расстройства обмена веществ и питания: гипертриглицеридемия;
- расстройства со стороны центральной нервной системы: возможна деменция, хорея, обострение эпилепсии;
- расстройства со стороны сосудов: артериальная тромбоэмболия;
- расстройства со стороны желудочно-кишечного тракта: панкреатит (у женщин с уже существующей гипертриглицеридемией)
- Со стороны кожи и подкожной клетчатки: мультиформная эритема
- нарушения со стороны почек и мочевыводящих путей: недержание мочи
- нарушения со стороны репродуктивной системы и молочных желез: фиброзно-кистозные изменения вмолочных железах, эрозия шейки матки;
- врожденные и наследственные генетические расстройства: ухудшение течения порфирии;
- отклонение от нормы, выявленные в результате обследования: повышенный общий уровень гормонов щитовидной железы.
Срок годности
3 года.
Условия хранения
Хранить в оригинальной упаковке при температуре не выше 30 ° С. Хранить в недоступном для детей месте.
Упаковка
Комби-упаковка: по 28 таблеток в упаковке (14 таблеток, покрытых пленочной оболочкой, белого цвета по 1 мг + 14 таблеток, покрытых оболочкой, серого цвета по 1 мг / 10 мг в блистере). По 1, 2 или 3 блистера в коробке.
Комби-упаковка: по 28 таблеток в упаковке (14 таблеток, покрытых оболочкой, кирпично-красного цвета по 2 мг + 14 таблеток, покрытых пленочной оболочкой, желтого цвета по 2 мг / 10 мг в блистере). По 1, 2 или 3 блистера в коробке.
Категория отпуска
По рецепту.
Производитель
Абботт Биолоджикалз Б.В. /Abbott Biologicals B.V.
Местонахождение производителя и его адрес места осуществления деятельности
Веервег 12, 8121 АА Ольст, Нидерланды/ Veerweg 12, 8121 AA Olst, The Netherlands.
© Перевод на русский язык выполнен редакторской командой apteka24.ua.
Источник: «Державний реєстр лікарських засобів України», 2020 г.