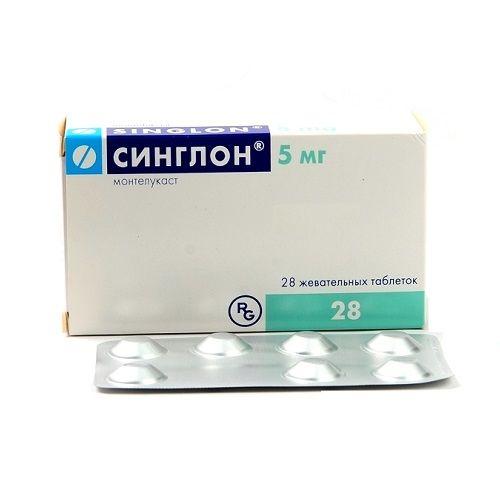
Синглон 5 мг №28 таблетки — Инструкция по применению
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
СИНГЛОН®
(SINGLON®)
Склад:
діюча речовина: монтелукаст;
1 таблетка жувальна по 4 мг містить 4 мг монтелукасту (у формі натрію монтелукасту – 4,16 мг);
1 таблетка жувальна по 5 мг містить 5 мг монтелукасту (у формі натрію монтелукасту – 5,2 мг);
допоміжні речовини: маніт (E 421), целюлоза мікрокристалічна, гідроксипропілцелюлоза, натрію кроскармелоза, ароматизатор вишневий (мальтодекстрин, крохмаль модифікований, мальтол), аспартам (E 951), заліза оксид жовтий (Е 172), магнію стеарат.
Лікарська форма. Таблетки жувальні.
Основні фізико-хімічні властивості:
• Синглон®, таблетки жувальні, 4 мг: таблетки жувальні, кремового кольору, овальні, двоопуклі, з рельєфним надписом «R 13» з одного боку; довжиною близько 11 мм, шириною близько
8 мм;
• Синглон®, таблетки жувальні, 5 мг: таблетки жувальні, кремового кольору, круглі, двоопуклі, з рельєфним надписом «R 14» з одного боку; діаметром близько 10 мм.
Фармакотерапевтична група. Засоби для системного застосування при обструктивних захворюваннях дихальних шляхів. Антагоністи лейкотрієнових рецепторів.
Код АТХ R03D C03.
Фармакологічні властивості.
Фармакодинаміка.
Цистеїніллейкотрієни (LTC4, LTD4, LTE4) є потужними ейкозаноїдами запалення, що виділяються різними клітинами, у тому числі опасистими клітинами та еозинофілами. Ці важливі проастматичні медіатори зв’язуються з цистеїніллейкотрієновими рецепторами (CysLT), присутніми у дихальних шляхах людини, і спричиняють такі реакції як бронхоспазм, гіперсекреція, посилення проникності судин і збільшення кількості еозинофілів.
Перорально введений монтелукаст є активною сполукою, яка з високою вибірковістю і хімічною спорідненістю зв’язується з CysLT1-рецепторами. Відомо, що монтелукаст пригнічує бронхоспазм після інгаляції LTD4 у дозі 5 мг. Бронходилатація спостерігається упродовж 2 годин після перорального застосування; цей ефект є адитивним до бронходилатації, спричиненої β-агоністами. Лікування монтелукастом пригнічувало як ранню, так і пізню фази бронхоконстрикції, спричиненої антигенною стимуляцією. Монтелукаст зменшує кількість еозинофілів периферичної крові у дорослих пацієнтів та дітей порівняно з плацебо. Відомо, що прийом монтелукасту значно зменшував кількість еозинофілів у дихальних шляхах (за аналізом мокротиння). У дорослих пацієнтів і дітей віком від 2 до 14 років монтелукаст зменшує кількість еозинофілів периферичної крові порівняно з плацебо та покращує клінічний контроль бронхіальної астми.
Лікування монтелукастом покращує денні та нічні симптоми астми, доповнює клінічний ефект інгаляційних кортикостероїдів, знижує річну частоту епізодів загострення астми і необхідність використання бета-агоніста.
Фармакокінетика.
Всмоктування
Монтелукаст швидко всмоктується після перорального прийому. Після застосування дорослими натще таблеток 10 мг, вкритих плівковою оболонкою, середня максимальна концентрація (Cmax) у плазмі крові досягалася через 3 години (Tmax). Середня біодоступність при пероральному застосуванні становила 64 %. Вживання звичайної їжі не впливало на біодоступність і на Cmax при пероральному застосуванні препарату. Безпека і ефективність були підтверджені під час клінічних досліджень, які проводилися із застосуванням таблеток 10 мг, вкритих плівковою оболонкою, незалежно від часу прийому їжі.
Для таблеток жувальних 5 мг, показник Cmax у дорослих досягався через 2 години після перорального прийому. Середня біодоступність у разі перорального застосування становить 73 % і знижується до 63 % у разі прийому зі звичайною їжею.
Після прийому натще таблеток жувальних 4 мг, у дітей віком від 2 до 5 років показник Cmaxдосягається через 2 години після прийому препарату. Середнє значення Cmax на 66 % вище, а середнє Cmin нижче, ніж у дорослих після прийому таблеток 10 мг.
Розподіл
Понад 99 % монтелукасту зв’язується з білками плазми крові. Об’єм розподілу монтелукасту у рівноважному стані в середньому становить від 8 до 11 літрів. У ході досліджень на щурах із застосуванням радіоактивно міченого монтелукасту, проникнення через гематоенцефалічний бар’єр було мінімальним. Крім того, концентрації міченого радіоізотопом матеріалу в усіх інших тканинах через 24 години після введення препарату також виявилися мінімальними.
Метаболізм
Монтелукаст активно метаболізується. Під час досліджень із застосуванням терапевтичних доз, метаболіти монтелукасту не виявляються у плазмі крові (у рівноважному стані) у дорослих пацієнтів і пацієнтів дитячого віку.
Цитохром Р450 2С8 є основним ферментом у метаболізмі монтелукасту. Крім того, цитохроми CYP ЗА4 і 2С9 відіграють незначну роль у метаболізмі монтелукасту, хоча ітраконазол (інгібітор CYP ЗА4) не змінював фармакокінетичні показники монтелукасту у здорових добровольців, які отримували 10 мг монтелукасту на добу. Згідно з результатами досліджень in vitro з використанням мікросом печінки людини, терапевтичні плазмові концентрації монтелукасту не пригнічують цитохроми Р450 ЗА4, 2С9, 1А2, 2А6, 2С19 і 2D6. Участь метаболітів у терапевтичній дії монтелукасту є мінімальною.
Виведення
Кліренс монтелукасту з плазми крові у здорових дорослих добровольців у середньому становить 45 мл/хв. Після перорального прийому монтелукасту, міченого ізотопом, 86 % речовини виводиться з калом протягом 5 днів і менше 0,2 % – із сечею. Цей факт у поєднанні з даними про біодоступність монтелукасту при пероральному застосуванні свідчить, що монтелукаст і його метаболіти майже повністю виводяться з жовчю.
Фармакокінетика у різних груп пацієнтів
Пацієнтам із порушенням функції печінки легкого і середнього ступеня тяжкості корекція дози не потрібна. Досліджень з участю пацієнтів з порушенням функції нирок не проводили. Оскільки монтелукаст і його метаболіти виводяться з жовчю, корекція дози для пацієнтів з порушенням функції нирок не вважається необхідною. Дані щодо фармакокінетики монтелукасту у пацієнтів з порушенням функції печінки тяжкого ступеня (понад 9 балів за класифікацією Чайлда-П’ю) відсутні.
У разі прийому високих доз монтелукасту (у 20 та 60 разів вищих за дозу, рекомендовану для дорослих) спостерігалося зниження концентрації теофіліну в плазмі крові. Цей ефект не відзначався у разі прийому рекомендованої дози 10 мг 1 раз на добу.
Клінічні характеристики.
Показання.
• Лікування бронхіальної астми:
– як додатковий засіб лікування бронхіальної астми у пацієнтів віком 2-5 років з персистуючою астмою легкого та середнього ступеня тяжкості, яка недостатньо контролюється інгаляційними кортикостероїдами, а також у разі недостатнього контролю астми короткодіючими β-агоністами, що застосовуються у разі потреби;
– як альтернативний засіб лікування, що заміняє низькі дози інгаляційних кортикостероїдів, у пацієнтів віком 2-5 років з персистуючою бронхіальною астмою легкого ступеня тяжкості, в яких останнім часом не відзначалося тяжких нападів бронхіальної астми, що вимагають застосування пероральних кортикостероїдів, а також у пацієнтів, які не можуть застосовувати інгаляційні кортикостероїди (див. розділ «Спосіб застосування та дози»).
• Профілактика бронхоспазму, спричиненого фізичним навантаженням, у пацієнтів старше 2 років.
• Полегшення симптомів сезонного та цілорічного алергічного риніту.
Протипоказання.
• Гіперчутливість до монтелукасту або до будь-якої з допоміжних речовин препарату.
• Дитячий вік до 2 років.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Синглон® можна призначати разом з іншими препаратами, що зазвичай застосовуються для профілактики або тривалого лікування бронхіальної астми. Під час досліджень взаємодії між лікарськими засобами клінічна доза монтелукасту не мала важливого клінічного впливу на фармакокінетику таких препаратів: теофілін, преднізон, преднізолон, пероральні контрацептиви (етинілестрадіол/норетиндрон 35/1), терфенадин, дигоксин та варфарин.
У пацієнтів, які одночасно приймали фенобарбітал, площа під кривою «концентрація-час» (AUC) для монтелукасту знижувалася приблизно на 40 %. Оскільки монтелукаст метаболізується за допомогою CYP ЗА4, 2С8 і 2С9, необхідно дотримуватися обережності, особливо стосовно дітей, якщо монтелукаст призначати одночасно з індукторами CYP ЗА4, 2С8 і 2С9, наприклад фенітоїном, фенобарбіталом і рифампіцином.
Дослідження in vitro продемонстрували, що монтелукаст є потужним інгібітором
CYP 2С8. Проте дані клінічного дослідження взаємодії лікарських засобів, що включають монтелукаст і розиглітазон (маркерний субстрат; препарат, що метаболізується за допомогою CYP 2С8), показали, що монтелукаст не є інгібітором CYP 2С8 in vivo. Таким чином, монтелукаст не впливає значною мірою на метаболізм препаратів, що метаболізуються за допомогою цього ферменту (наприклад паклітакселу, розиглітазону та репаглініду).
Під час досліджень in vitro було встановлено, що монтелукаст є субстратом CYP 2С8 і меншою мірою 2С9 та ЗА4. У ході клінічного дослідження взаємодії лікарських засобів із застосуванням монтелукасту і гемфіброзилу (інгібітору CYP 2C8 і 2С9), гемфіброзил підвищував системний вплив монтелукасту у 4,4 раза. У разі одночасного застосування з гемфіброзилом або іншими потужними інгібіторами CYP 2С8, корекція дози монтелукасту не потрібна, але лікар повинен враховувати підвищений ризик виникнення побічних реакцій.
За результатами досліджень in vitro, не очікується виникнення клінічно важливих взаємодій з менш потужними інгібіторами CYP 2C8 (наприклад, з триметопримом). Одночасне застосування монтелукасту з ітраконазолом, потужним інгібітором CYP ЗА4, не призводило до істотного підвищення системного впливу монтелукасту.
Особливості застосування.
Пацієнтів необхідно попередити, що Синглон® для перорального застосування ніколи не слід використовувати для лікування гострих нападів бронхіальної астми, а також про те, що вони повинні завжди мати при собі відповідний препарат невідкладної допомоги. У разі гострого нападу слід застосовувати інгаляційні β-агоністи короткої дії. Пацієнти повинні якнайшвидше проконсультуватися з лікарем, якщо вони потребують більшої кількості β-агоніста короткої дії, ніж зазвичай.
Не слід різко замінювати монтелукастом терапію інгаляційними або пероральними кортикостероїдами.
Відсутні дані на підтвердження того, що дозу пероральних кортикостероїдів можна зменшувати у разі одночасного застосування монтелукасту.
Повідомлялося про виникнення психоневрологічних явищ у пацієнтів, які приймають Синглон® (див. розділ «Побічні реакції»). Оскільки на ці явища можуть впливати інші фактори, невідомо, чи пов’язані ці явища із застосуванням препарату Синглон®. Лікарі повинні обговорити ці небажані явища зі своїми пацієнтами та/або їх доглядальниками. Пацієнтам та/або доглядальникам слід надати вказівки про те, щоб вони повідомляли своєму лікарю про виникнення таких змін.
У поодиноких випадках у пацієнтів, які отримують протиастматичні засоби, у тому числі монтелукаст, може спостерігатися системна еозинофілія, інколи супроводжувана клінічними проявами васкуліту (так званий синдром Чарга-Строса), лікування якого здійснюється шляхом системної кортикостероїдної терапії. Такі випадки зазвичай (але не завжди) були пов’язані зі зменшенням дози або припиненням застосування кортикостероїдного препарату. Можливий взаємозв’язок між антагоністами лейкотрієнових рецепторів та появою синдрому Чарга-Строса неможливо спростувати або підтвердити. Лікарі повинні пам’ятати про можливість виникнення у пацієнтів еозинофілії, васкулітного висипу, погіршання легеневої симптоматики, ускладнень з боку серця та/або нейропатії. Пацієнтів, у яких виникли такі симптоми, слід повторно обстежити і переглянути їх схему лікування.
Лікування монтелукастом не дозволяє пацієнтам з аспірин-залежною бронхіальною астмою застосовувати аспірин або інші нестероїдні протизапальні засоби.
Синглон® містить аспартам, який є джерелом фенілаланіну. Пацієнтам, хворим на фенілкетонурію, необхідно враховувати, що 1 таблетка жувальна по 4 мг містить
аспартам у кількості, еквівалентній 0,674 мг фенілаланіну на дозу; 1 таблетка жувальна по 5 мг містить аспартам у кількості, еквівалентній 0,842 мг фенілаланіну на дозу.
Застосування у період вагітності або годування груддю.
Вагітність. Дослідження на тваринах не продемонстрували будь-якого шкідливого впливу препарату на вагітність або розвиток ембріона/плода.
Обмежена інформація, знайдена у базі даних вагітностей, не вказує на причинно-наслідковий зв’язок між застосуванням монтелукасту і виникненням мальформацій (таких як дефекти кінцівок), про які рідко повідомлялося за даними всесвітнього післяреєстраційного досвіду застосування препарату.
Синглон®можна застосовувати у період вагітності лише у тому разі, якщо це вважається абсолютно необхідним.
Годування груддю. Дослідження на щурах продемонстрували, що монтелукаст проникає у грудне молоко. Невідомо, чи виводиться монтелукаст з грудним молоком у жінок.
Синглон® можна застосовувати у період годування груддю лише у тому разі, якщо це вважається абсолютно необхідним.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Не очікується впливу монтелукасту на здатність керувати автомобілем або іншими механізмами. Проте у окремих пацієнтів може виникати сонливість та/або запаморочення, таким пацієнтам під час прийому препарату Синглон® слід утриматися від керування автомобілем або іншими механізмами.
Спосіб застосування та дози.
Препарат необхідно застосовувати дітям під наглядом дорослих.
Пацієнтам з бронхіальною астмою та алергічним ринітом (сезонним та цілорічним) необхідно приймати 1 таблетку жувальну 4 мг 1 раз на добу. Для полегшення симптомів алергічного риніту час прийому слід підбирати індивідуально.
Для лікування бронхіальної астми доза для дітей віком від 2 до 5 років становить
1 жувальну таблетку (4 мг) на добу, ввечері. Синглон® слід приймати за 1 годину до їди або через 2 години після їди. Корекція дози для цієї вікової групи не вимагається. Препарат Синглон® у лікарській формі «таблетки жувальні» (4 мг) не рекомендований для дітей віком до 2 років.
Діти віком 6-14 років: 1 таблетка жувальна (5 мг) 1 раз на добу (увечері, за 1 годину до або
2 години після вживання їди). Підбирати дозування цій віковій групі не потрібно.
Загальні рекомендації. Терапевтичний вплив препарату Синглон® на показники контролю бронхіальної астми настає впродовж 1 дня. Пацієнтам слід рекомендувати продовжувати приймати препарат Синглон®, навіть якщо контроль астми досягнутий, а також у періоди загострення астми.
Немає необхідності у корекції дози пацієнтам із порушенням функції нирок або з порушеннями функції печінки від легкого до середнього ступеня. Дані стосовно пацієнтів з порушенням функції печінки тяжкого ступеня відсутні. Для хлопчиків і дівчаток застосовуються однакові дози.
Альтернативний метод лікування замість низькодозових інгаляційних кортикостероїдів у разі персистуючої бронхіальної астми легкого ступеня. Монтелукаст не рекомендований як монотерапія для пацієнтів з персистуючою астмою помірного ступеня. Застосування монтелукасту як альтернативи низькодозовим інгаляційним кортикостероїдам дітям із персистуючою бронхіальною астмою легкого ступеня слід розглядати тільки для пацієнтів, у яких за останній час не було серйозних нападів бронхіальної астми, що вимагали застосування пероральних кортикостероїдів, і які не можуть застосовувати інгаляційні кортикостероїди. Персистуюча бронхіальна астма легкого ступеня визначається як виникнення симптомів астми частіше 1 разу на тиждень, але рідше 1 разу на добу, виникнення нічних симптомів частіше 2 разів на місяць, але рідше 1 разу на тиждень, і нормальна функція легенів у періодах між епізодами бронхіальної астми. Якщо достатнього контролю астми не досягнуто, у подальшому (зазвичай впродовж 1 місяця) слід визначити необхідність у додатковій або іншій протизапальній терапії, ґрунтуючись на послідовному лікуванні симптомів бронхіальної астми. Слід періодично оцінювати стан пацієнтів на предмет контролю бронхіальної астми.
Профілактика бронхіальної астми у пацієнтів віком від 2 до 5 років, у яких основним компонентом бронхіальної астми є бронхоспазм, індукований фізичним навантаженням. Синглон® рекомендований пацієнтам віком від 2 до 5 років для профілактики бронхоспазму, індукованого фізичним навантаженням, який може бути основним проявом персистуючої бронхіальної астми, що вимагає застосування інгаляційних кортикостероїдів. Стан пацієнтів слід оцінити після 2-4 тижнів лікування монтелукастом. Якщо достатньої реакції не досягнуто, слід розглянути питання про додаткову або іншу терапію.
Лікування препаратом Синглон® залежно від інших засобів лікування бронхіальної астми. Якщо препарат Синглон® застосовується як додатковий засіб до інгаляційних кортикостероїдів, Синглон® не повинен різко заміняти інгаляційні кортикостероїди.
Діти. Препарат Синглон®, таблетки жувальні, по 4 мг застосовувати дітям віком від 2 до 5 років.
Препарат Синглон®, таблетки жувальні, по 5 мг застосовувати дітям віком від 6 до 14 років.
Безпека та ефективність у дітей віком до 2-х років не встановлені.
Передозування.
Спеціальна інформація щодо передозування препарату Синглон® відсутня. У ході досліджень хронічної бронхіальної астми монтелукаст призначали у дозах до 200 мг/добу дорослим пацієнтам протягом 22 тижнів, а у короткочасних дослідженнях – у дозах до
900 мг/добу протягом приблизно 1 тижня; ці дози не спричиняли будь-яких клінічно важливих побічних реакцій.
Протягом періоду післяреєстраційного застосування та під час клінічних досліджень надходили повідомлення про гостре передозування монтелукасту. Вони включали прийом препарату дорослими і дітьми у дозах, що перевищують 1000 мг (приблизно 61 мг/кг у дитини віком 42 місяці). Отримані клінічні і лабораторні дані відповідали профілю безпеки у дорослих пацієнтів і дітей. У більшості випадків передозування про побічні реакції не повідомлялося. Найчастіше спостерігалися побічні реакції, що відповідали профілю безпеки монтелукасту, які включали: біль у животі, сонливість, спрагу, головний біль, блювання та психомоторну гіперактивність.
Невідомо, чи виводиться монтелукаст за допомогою перитонеального діалізу або гемодіалізу.
Побічні реакції.
Про побічні реакції повідомлялося з частотою >1/100–
• інфекційні та паразитарні захворювання: інфекції верхніх дихальних шляхів;
• з боку крові та лімфатичної системи: підвищена схильність до кровотеч;
• з боку імунної системи: реакції гіперчутливості, у тому числі анафілаксія, еозинофільна інфільтрація печінки;
• психічні порушення: порушення сну, незвичайні сновидіння, включаючи нічні кошмари, галюцинації, психомоторна гіперактивність, дратівливість, неспокій, ажитація, у тому числі агресивна поведінка або ворожість, тремор, занепокоєння, депресія, безсоння, сомнамбулізм (сноходіння) погіршення/втрата пам’яті, порушення уваги, гнів, нетерплячість, дезорієнтація, суїцидальні думки та поведінка (спроба суїциду);
• з боку нервової системи: головний біль, запаморочення, сонливість, парестезія/гіпестезія, судоми, млявість;
• з боку серця: відчуття серцебиття;
• з боку кишково-шлункового тракту: біль у животі, діарея, сухість у роті, розлади травлення, диспепсія, нудота, блювання;
• з боку печінки та жовчовивідних шляхів: підвищення рівнів трансаміназ у плазмі крові (AЛТ, AСТ), гепатит (включаючи холестатичне, гепатоцелюлярне та змішане ураження печінки);
• з боку шкіри та підшкірної клітковини: ангіоневротичний набряк, схильність до появи синців, кропив’янка, свербіж, шкірний висип, вузликова еритема, мультиформна еритема;
• з боку нирок та сечових шляхів: енурез у дітей;
• з боку скелетно-м’язової системи і сполучної тканини: артралгія, міалгія, у тому числі м’язові спазми;
• загальні порушення і порушення у місці введення: астенія/підвищена втомлюваність, нездужання, набряки, спрага, гіпертермія.
Під час лікування монтелукастом пацієнтів із бронхіальною астмою повідомлялося про поодинокі випадки появи синдрому Чарга-Строса (див. розділ «Особливості застосування»).
Термін придатності. 2 роки.
Умови зберігання.
Зберігати при температурі не вище 25 оС в оригінальній упаковці для захисту від впливу світла та вологи.
Зберігати у недоступному для дітей місці.
Упаковка. По 14 (7×2), 28 (7×4) або 56 (7×8) таблеток у блістерах, у картонній упаковці.
Категорія відпуску. За рецептом.
Виробник. ТОВ «Гедеон Ріхтер Польща».
Місцезнаходження виробника та його адреса місця провадження діяльності.
вул. кн. Ю. Понятовського, 5, Гродзиськ Мазовецький, 05-825, Польща.
Виробник. ВАТ «Гедеон Ріхтер», Угорщина.
Місцезнаходження виробника та його адреса місця провадження діяльності.
Н-1103, Будапешт, вул. Демреї, 19-21, Угорщина.
Заявник
ВАТ «Гедеон Ріхтер», Угорщина.
Місцезнаходження заявника та/або представника заявника.
Н-1103, Будапешт, вул. Демреї, 19-21, Угорщина.