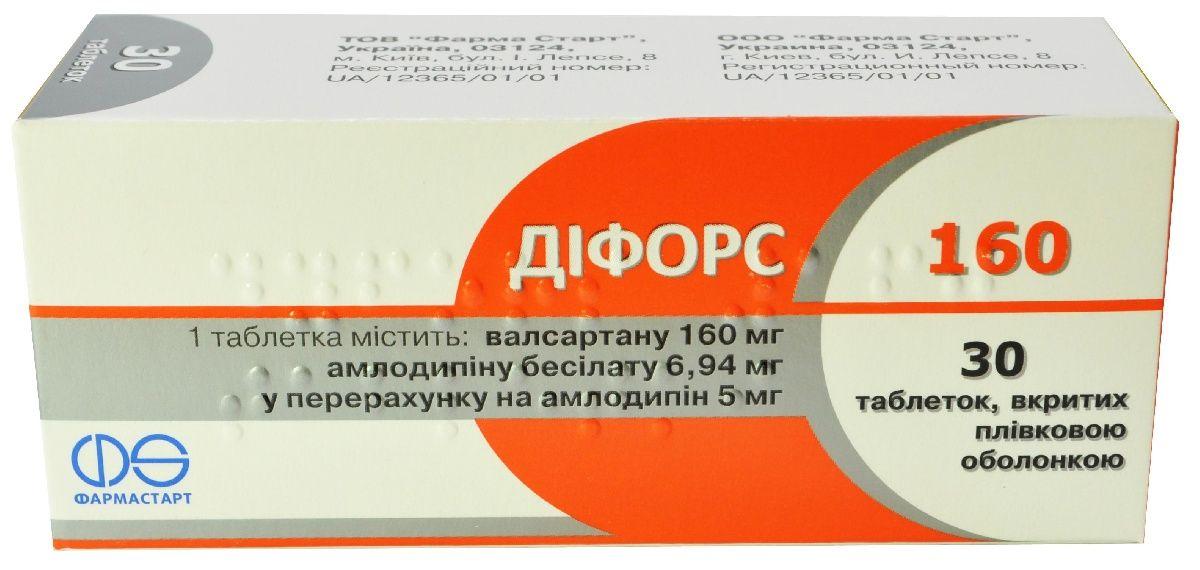
Дифорс 160 5 мг/160 мг №30 таблетки — Инструкция по применению
ІНСТРУКЦІЯ
для медичного застосування препарату
ДІФОРС 80
ДІФОРС 160
ДІФОРС XL
(DIFORS 80)
(DIFORS 160)
(DIFORS XL)
Склад:
діючі речовини: амлодипіну бесілат та валсартан;
1 таблетка містить амлодипіну бесілату 6,94 мг у перерахуванні на амлодипін 5 мг та 80 мг валсартану або амлодипіну бесілату 6,94 мг у перерахуванні на амлодипін 5 мг та 160 мг валсартану, або амлодипіну бесілату 13,88 мг у перерахуванні на амлодипін 10 мг та 160 мг валсартану;
допоміжні речовини: кальцію гідрофосфат дигідрат, целюлоза мікрокристалічна, натрію кроскармелоза, гідроксипропілметилцелюлоза, кремнію діоксид колоїдний безводний, тальк, магнію стеарат, покриття для нанесення оболонки Opadry II White (поліетиленгліколь, спирт полівіниловий, тальк, титану діоксид Е171).
Лікарська форма. Таблетки, вкриті плівковою оболонкою.
Фармакотерапевтична група. Комбіновані препарати інгібіторів ангіотензину ІІ.
Код АТС С09D B01.
Клінічні характеристики.
Показання.
Есенціальна гіпертензія у пацієнтів, артеріальний тиск яких не регулюється монопрепаратом.
Протипоказання.
Підвищена чутливість до будь-якого з компонентів препарату. Вагітність. Період годування груддю.
Спосіб застосування та дози.
Пацієнти, у яких артеріальний тиск неадекватно регулюється монопрепаратами амлодипіну або валсартану, можуть бути переведені на комбіновану терапію препаратом Діфорс. Рекомендована доза — 1 таблетка на добу. Рекомендується приймати Діфорс, запиваючи його водою.
Пацієнтів, які приймають валсартан і амлодипін окремо, можна перевести на Діфорс, який містить ті ж самі дози компонентів.
Для пацієнтів літнього віку рекомендовані звичайні дозові схеми.
Максимальна добова доза – 1 таблетка Діфорс 80 або 1 таблетка Діфорс 160 або 1 таблетка Діфорс XL (максимально допустимі дози компонентів препарату — 10 мг за вмістом амлодипіну, 320 мг за вмістом валсартану).
Побічні реакції.
Приведені нижче побічні реакції класифіковані за органами, системами та частотою виникнення, причому найпоширеніші вказані першими. При оцінюванні частоти виникнення побічних реакцій використані такі критерії: дуже поширені (≥ 1/10); поширені (> 1/100, ≤ 1/10), непоширені (> 1/1000, ≤ 1/100), рідко поширені (>1/10000, ≤ 1/1000), дуже рідко поширені (
Інфекції:поширені — назофарингіт, грипоподібні симптоми.
З боку імунної системи:рідко поширені – гіперчутливість.
З боку органа зору:рідко поширені — порушення зору.
З боку психіки:рідко поширені – збудження.
З боку нервової системи:поширені — головний біль; непоширені — запаморочення, сонливість, постуральнe запаморочення, парестезія.
З боку органа слуху і лабіринту: непоширені – запаморочення; рідко поширені — шум у вухах.
З боку серця: непоширені — тахікардія; рідко поширені – непритомність.
З боку судин: непоширені — ортостатична гіпотензія; рідко поширені — артеріальна гіпотензія.
З боку дихальної системи: непоширені — кашель, біль у горлі і гортані.
З боку травної системи: непоширені — абдомінальний біль, запор, діарея, нудота, сухість у роті.
З боку шкіри і підшкірних тканин: непоширені — висипання, еритема; рідко поширені — підвищена пітливість, кропив’янка, висипання, екзантема.
З боку кістково-м’язової системи: непоширені — припухлість суглобів, біль у спині, артралгія; рідко поширені — м’язові судоми, відчуття тяжкості.
З боку нирок і сечовидільної системи: рідко поширені – більш часте сечовипускання, підвищене виділення сечі, підвищення азоту сечовини.
З боку репродуктивної системи: рідко поширені — порушення ерективної функції.
Загальні порушення: рідко поширені — набряки, набряк обличчя, набряк нижніх кінцівок, стомлюваність, «гарячі» припливи, астенія.
Діфорс може спричиняти побічні реакції, раніше відзначені для одного з компонентів препарату (див. відповідні інструкції для медичного застосування на монопрепарати).
Передозування.
До теперішнього часу відсутній досвід вивчення передозування Діфорс. Далі приведена інформація, яка стосується діючих речовин препарату.
Симптоми. Основним симптомом передозування валсартану, ймовірно, є виражена артеріальна гіпотензія із запамороченням. Передозування амлодипіну може призвести до наростаючої периферичної вазодилатації і, ймовірно, до рефлекторної тахікардії. Повідомляли про значну і потенційно пролонговану системну гіпотензію, аж до шоку і фатального результату при передозуванні амлодипіном.
Лікування. Якщо препарат прийнято нещодавно, слід викликати блювання або промити шлунок. Всмоктування амлодипіну значно знижується при застосуванні активованого вугілля відразу ж або впродовж двох годин після прийому амлодипіну.
Клінічно значуща гіпотензія, спричинена передозуванням Діфорс, вимагає активної підтримки стану серцево-судинної системи, включаючи частий контроль серцевої і дихальної функцій, підйом кінцівок, уваги до об’єму циркулюючої рідини і сечовипускання. Для відновлення судинного тонусу і артеріального тиску може бути застосований судинозвужуючий препарат при відсутності протипоказань для його застосування. При стійкому зниженні артеріального тиску, яке є наслідком блокади кальцієвих каналів, може бути доцільним внутрішньовенне введення кальцію глюконату.
Застосування у період вагітності або годування груддю.
Як і будь-який препарат, який прямо впливає на систему ренін-ангіотензин-альдостерон (РААС), Діфорс не застосовують при вагітності або у жінок, які планують вагітність.
Лікарі повинні попереджати жінку, яка планує вагітність, про потенційний ризик для майбутньої дитини при прийманні препарату. Якщо в процесі терапії встановлена вагітність, прийом Діфорс необхідно негайно припинити.
Не відомо, чи проникає валсартан і/або амлодипін у грудне молоко, тому не рекомендується застосовувати препарат в період годування груддю. У разі, якщо терапія препаратом необхідна для матері, годування груддю слід припинити.
Діти.
Препарат не рекомендовано призначати дітям через відсутність даних щодо безпечності та ефективності.
Особливості застосування.
Пацієнти з дефіцитом в організмі натрію і/або об’єму циркулюючої крові.
У пацієнтів з неускладненою артеріальною гіпертензією спостерігалася надмірна гіпотензія. У пацієнтів з активованою ренін-ангіотензиновою системою (з пониженим вмістом натрію і/або об’ємом та які одержують високі дози діуретиків), які приймають блокатори ангіотензин-рецепторів, може виникати симптоматична гіпотензія. Рекомендована корекція цього стану перед застосуванням Діфорс або ретельне медичне спостереження на початку терапії.
При виникненні артеріальної гіпотензії при застосуванні Діфорс пацієнта слід покласти на спину і, якщо необхідно, провести внутрішньовенну інфузію фізіологічного розчину. Лікування продовжувати до стабілізації артеріального тиску.
Гіперкаліємія.
Слід з обережністю проводити одночасне лікування калієвими добавками, калій-зберігаючими діуретиками, сольовими замінниками, що містять калій, або іншими препаратами, які можуть підвищувати рівень калію (гепарин та ін.), а також передбачити частий контроль вмісту калію.
Відміна бета-блокаторів.
Амлодипін не є бета-блокатором і тому не захищає від небезпеки раптової відміни бета-блокаторів, тому дозу бета-блокатора необхідно знижувати поступово.
Стеноз ниркової артерії.
Відсутні дані про застосування Діфорс у пацієнтів з однобічним або двобічним стенозом ниркової артерії.
Трансплантація нирки.
Досвід безпечного застосування Діфорс у пацієнтів з недавно перенесеною трансплантацією нирки відсутній.
Порушення функції печінки.
Валсартан виводиться, головним чином, в незміненому стані з жовчю, тоді як амлодипін інтенсивно метаболізується в печінці. Особлива обережність необхідна при застосуванні Діфорс у пацієнтів з порушенням функції печінки або обструктивними порушеннями жовчного міхура.
Порушення функції нирок.
Для пацієнтів зі слабкими і помірними порушеннями функції нирок немає необхідності в коригуванні дози Діфорс. Для пацієнтів із тяжкими порушеннями функції нирок (кліренс креатиніну менше 10 мл/хв) дані щодо застосування препарату відсутні, тому рекомендується бути обережними.
Стеноз аорти і мітрального клапана, обструктивна гіпертрофічна кардіоміопатія.
Як і при лікуванні іншими вазодилататорами, особливо обережними повинні бути пацієнти, у яких констатований стеноз аорти або стеноз мітрального клапана, або при обструктивній гіпертрофічній кардіоміопатії.
З обережністю слід застосовувати препарат при нестабільній стенокардії.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Дослідження щодо впливу препарату на здатність керувати автотранспортом і працювати з потенційно небезпечними механізмами не проводилися. Однак пацієнти, у яких виникає запаморочення чи відчуття слабкості після прийому препарату, повинні утримуватися від керування автотранспортом та роботи з потенційно небезпечними механізмами.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Амлодипін.
При монотерапії амлодипіном не встановлені клінічно значущі лікарські взаємодії з наступними препаратами: тіазидні діуретики, бета-блокатори, інгібітори АПФ, нітрати тривалої дії, сублінгвальний нітрогліцерин, дигоксин, варфарин, аторвастатин, силденафіл; комбіновані антацидні препарати, які містять алюмінію гідроксиду гель, магнію гідроксид, симетикон; циметидин, НПЗЗ, антибіотики, пероральні гіпоглікемічні засоби.
Валсартан.
При монотерапії валсартаном не встановлені клінічно значущі лікарські взаємодії з наступними препаратами:
циметидин, варфарин, фуросемід, дигоксин, атенолол, індометацин, гідрохлортіазид, амлодипін, глібенкламід.
Одночасне застосування з калієвими добавками, калійзберігаючими діуретиками, сольовими замінниками, що містять калій, або іншими препаратами, які можуть підвищувати рівень калію (гепарин та ін.), вимагає обережності. Слід передбачати частий контроль рівнів вмісту калію.
Фармакологічні властивості.
Фармакодинаміка. Діфорс містить два антигіпертензивні компоненти з додатковими механізмами контролю артеріального тиску у пацієнтів з есенціальною гіпертензією: амлодипін належить до класу антагоністів кальцію, а валсартан — до класу антагоністів ангіотензину ІІ. Комбінація цих інгредієнтів має адитивний антигіпертензивний ефект, знижуючи артеріальний тиск більшою мірою, ніж кожен із компонентів окремо.
Амлодипін.
Амлодипін інгібує трансмембранне проникнення іонів кальцію в гладкі м’язи серця і судин. Механізм антигіпертензивної дії амлодипіну обумовлений прямим релаксуючим впливом на гладкі м’язи судин, що зумовлює зменшення периферичного судинного опору і призводить до зниження артеріального тиску. Експериментальні дані підтверджують, що амлодипін зв’язується по дигідропіридинових і негідропіридинових місцях зв’язку. Скоротливі процеси серцевого м’яза і гладких м’язів судин залежать від проходження позаклітинного кальцію в ці клітини через специфічні іонні канали.
Після введення терапевтичних доз пацієнтам з есенціальною гіпертензією амлодипін спричиняє вазодилатацію, що призводить до зниження артеріального тиску в положеннях лежачи і стоячи. Таке зниження артерального тиску не супроводжується істотною зміною швидкості серцевих скорочень або рівнів катехоламінів у плазмі при тривалому дозуванні.
Ефект корелює з концентраціями в плазмі у пацієнтів молодого і літнього віку.
У пацієнтів з нормальною функцією нирок терапевтичні дози амлодипіну призводять до зниження ренального судинного опору і підвищення рівня гломерулярної фільтрації, а також ефективного ниркового потоку плазми без змін фракції, що фільтрується, або протеїнурії.
Вимірювання гемодинаміки серцевої функції у спокої та при навантаженні у пацієнтів з нормальною функцією шлуночків, пролікованих амлодипіном, в цілому показали невелике підвищення серцевого індексу без істотного впливу на dP/dt або на лівошлуночковий і діастолічний тиск або об’єм. У гемодинамічних дослідженнях амлодипін не виявляв негативного інотропного ефекту при застосуванні терапевтичних доз у інтактних тварин та людей, навіть при сумісному введенні з бета-блокаторами.
Амлодипін не змінює функцію синусно-передсердного вузла або передсердно-шлуночкової провідності у здорових тварин або людини. При застосуванні амлодипіну в комбінації з бета-блокаторами у пацієнтів з есенціальною гіпертензією або стенокардією, змін показників електрокардіограми не відзначено.
Спостерігалися позитивні клінічні ефекти амлодипіну у пацієнтів з хронічною стабільною стенокардією, вазоспастичною стенокардією та ішемічною хворобою, що була підтверджена ангіографічно.
Валсартан.
Валсартан є активним і специфічним антагоністом рецепторів ангіотензину ІІ, що призначений для внутрішнього застосування. Він діє вибірково на рецептори підтипу АТ1,які рідко поширені і є відповідальними за ефекти ангіотензину ІІ. Підвищені рівні ангіотензину II внаслідок блокади АТ1-рецепторів валсартаном можуть стимулювати вільні АТ2-рецептори, що врівноважує ефект АТ1-рецепторів. Валсартан не має будь-якої часткової активності агоніста відносно АТ1-рецепторів і має набагато більшу (приблизно у 20000 разів) спорідненість з АТ1-рецепторами, ніж з АТ2-рецепторами.
Валсартан не пригнічує АПФ, відомий також під назвою кінінази ІІ, який перетворює ангіотензин І в ангіотензин ІІ і руйнує брадикінін. Не спостерігається ніяких побічних ефектів, зумовлених брадикініном. Валсартан не вступає у взаємодію і не блокує рецептори інших гормонів або іонні канали, які, як відомо, відіграють важливу роль у регуляції функцій серцево-судинної системи.
Призначення препарату пацієнтам з артеріальною гіпертензією призводить до зниження артеріального тиску, не впливаючи при цьому на частоту пульсу.
У більшості пацієнтів після призначення внутрішньо разової дози препарату початок антигіпертензивної активності відзначається в межах 2 годин, а максимальне зниження артеріального тиску досягається в межах 4-6 годин.
Антигіпертензивний ефект зберігається більше 24 годин після прийому разової дози. За умови регулярного застосування препарату максимальний терапевтичний ефект звичайно досягається протягом 2-4 тижнів і утримується на досягнутому рівні в ході тривалої терапії. Раптова відміна валсартану не призводить до відновлення артеріальної гіпертензії або до інших побічних клінічних явищ.
Валсартан/амлодипін.
Комбінація амлодипіну бесілат/валсартан у пацієнтів із артеріальною гіпертензією спричиняє антигіпертензивний ефект впродовж приблизно 24 годин. Раптова відміна препарату не призводить до швидкого підвищення артеріального тиску.
У пацієнтів, у яких артеріальний тиск адекватно контролюється амлодипіном, при неприйнятних набряках комбінована терапія може забезпечити аналогічний контроль артеріального тиску при зменшенні набряків.
Фармакокінетика.
Лінійність. Валсартан і амлодипін проявляють лінійність фармакокінетики.
Амлодипін.
Всмоктування.Після внутрішнього застосування терапевтичних доз амлодипіну пік концентрації його в плазмі досягається протягом 6-12 годин. Розрахована абсолютна біодоступність становить від 64 % до 80 %. Їжа істотно впливає на біодоступність амлодипіну.
Розподіл. Об’єм розподілу становить приблизно 21 л/кг. У пацієнтів, хворих на есенціальну гіпертензію, приблизно 97,5 % циркулюючого препарату зв’язується з білками плазми.
Біотрансформація.Амлодипін інтенсивно (приблизно 90%) метаболізується в печінці до неактивних метаболітів.
Виведення.Виведення амлодипіну з плазми двофазне, з періодом напіввиведення приблизно 30-50 годин. Рівноважні рівні в плазмі досягаються після постійного введення протягом 7-8 днів. 10 % початкового амлодипіну і 60 % метаболітів амлодипіну виводяться з сечею.
Валсартан.
Всмоктування.Після прийому препарату внутрішньо пік концентрації валсартану в плазмі досягається протягом 2-4 годин. Середня величина абсолютної біодоступності препарату становить 23 %. Фармакокінетична крива валсартану має низхідний мультиекспоненційний характер (час напіввиведення Т1/2a 1/2b приблизно 9 годин). Їжа знижує експозицію, як показано по AUC (концентрація в плазмі — час) валсартану приблизно на 40 %, а пік концентрації в плазмі (Смакс) — на 50 %, хоча через 8 годин після застосування концентрація валсартану в плазмі однакова для групи, яка приймала препарат натщесерце і групи пацієнтів, які приймали препарат після їди. Зниження AUC не супроводжується клінічно значущим зниженням терапевтичного ефекту, тому валсартан можна приймати незалежно від прийому їжі.
Розподіл. Рівноважний об’єм розподілу валсартану після внутрішньовенного введення становить приблизно 17 л, що вказує на те, що валсартан розподіляється в тканинах не інтенсивно. Валсартан міцно зв’язується з білками плазми (94-97 %), головним чином, з сироватковим альбуміном.
Біотрансформація.Валсартан значною мірою не трансформується, оскільки тільки 20 % дози переходить в метаболіти. У плазмі в низьких концентраціях (менше 10 % від AUC валсартану) ідентифікований гідроксиметаболіт, який фармакологічно неактивний.
Виведення. Валсартан виводиться, головним чином, в незміненому стані з калом (приблизно 83 % від дози) і сечею (близько 13 % від дози). Після внутрішньовенного введення кліренс валсартану в плазмі становить приблизно 2 л/год, а його ренальний кліренс — приблизно 0,62 л/год (приблизно 30 % від загального кліренсу). Період напіввиведення валсартану – 6 годин.
Валсартан/амлодипін.
Після перорального застосування Діфорс пік концентрації в плазмі валсартану і амлодипіну досягається за 3 і 6-8 годин відповідно. Швидкість і ступінь всмоктування Діфорс еквівалентні біодоступності валсартану і амлодипіну.
Ниркова недостатність.
Порушення функції нирок істотно не впливають на фармакокінетику амлодипіну. Відсутня реальна кореляція між станом функції нирок (вимірюють за кліренсом креатиніну) і експозицією (визначають за AUC) при застосуванні валсартану у пацієнтів з порушеннями функції нирок різного ступеня. Тому пацієнти зі слабкими і помірними порушеннями функції нирок приймають звичайну початкову дозу.
Порушення функції печінки.
У пацієнтів з печінковою недостатністю знижується кліренс амлодипіну, що призводить до підвищення AUC приблизно на 40-60 %. У пацієнтів зі слабкими і помірними хронічними захворюваннями печінки експозиція (визначена за значеннями AUC) валсартану, в середньому, вдвічі перевищує таку у здорових добровольців. Пацієнти, які мають захворювання печінки, повинні бути обережними при застосуванні препарату.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості:
Таблетки круглої форми з двоопуклою поверхнею, вкриті плівковою оболонкою білого кольору.
Термін придатності.
2 роки.
Умови зберігання. Зберігати в недоступному для дітей місці, в оригінальній упаковці при температурі не вище 25 °C.
Упаковка. По 10 таблеток у блістері; по 1 або 3 блістери у картонній пачці.
Категорія відпуску. За рецептом.
Виробник. ТОВ «Фарма Старт», Україна.